|
||||||||||||||||||||||||||||
|
บทคัดย่อ |
||||||||||||||||||||||||||||
|
ระบบผสมพันธุ์ของไม้สะเดาไทย (Azadirachta indica var. siamensis) ได้ดำเนินการศึกษาที่แปลงทดลองปลูกรวบรวมพันธุ์ไม้สะเดาไทย (gene bank) ของศูนย์วนวัฒนวิจัยที่ 3 อ.ท่าม่วง จ.กาญจนบุรี โดยคัดเลือกไม้สะเดาไทยจำนวน 5 โคลน (clone) (V10, V35, V63, V70 และ V71) ไม้สะเดาไทยซึ่งนำปลูกในท้องที่ จ.กาญจนบุรี ออกดอกในช่วงปลายเดือนธันวาคม - กุมภาพันธ์ โดยมีช่วงออกดอกและช่วงดอกบานสูงสุด (peak flowering and anthesis period) ในเดือนกุมภาพันธ์ ดอกไม้สะเดาไทยมีลักษณะช่อดอกแบบ compound panicle แต่ละช่อดอกประกอบด้วยดอกย่อย จำนวน 680 - 840 ดอก ดอกสะเดาไทยเป็นดอกสมบูรณ์เพศ (complete flower) ประกอบด้วยกลีบเลี้ยง (sepal) และกลีบดอก (petal) จำนวนอย่างละ 5 กลีบ เกสรตัวผู้ (stamen) เรียงล้อมรอบเกสรตัวเมีย (pistil) โดยปกติดอกเริ่มบานตั้งแต่เวลาประมาณ 17.00 - 18.00 น. และบานเต็มที่ในช่วงเวลา 20.00 - 21.00 น. จากการศึกษาระยะการพัฒนาและตำแหน่งของเกสรตัวผู้และตัวเมียพบว่า ดอกไม้สะเดาไทยมีลักษณะแบบ protandry โดยอับละอองเรณูแตกก่อนระยะพร้อมผสมเกสรของเกสรตัวเมียประมาณ 2 - 3 ชั่วโมง และส่วนยอดเกสรตัวเมีย (stigma) อยู่ในตำแหน่งต่ำกว่าส่วนปลายของอับละอองเรณูเพียงเล็กน้อยเท่านั้น ซึ่งลักษณะดังกล่าวมีส่วนส่งเสริมการผสมเกสรภายในดอกเดียวกัน (self - pollination) อย่างไรก็ตามจากการศึกษาการควบคุมการผสมเกสร (controlled - pollination) พบว่าดัชนีความล้มเหลวจากการผสมพันธุ์ภายในต้นเดียวกัน (index of self - incompatibility, ISI) ของไม้สะเดาไทยมีค่าเท่ากับ 0.13 ซึ่งจัดไม้สะเดาไทยอยู่ในกลุ่มที่มีระบบผสมพันธุ์แบบ mostly self - incompatibility (ISI< 0.2) กล่าวคือ ไม้สะเดาไทยมีระบบการผสมพันธุ์โดยหลักเป็นแบบผสมข้าม (outcrossing) แต่การผสมพันธุ์ภายในต้นเดียวกัน (selfing) สามารถเกิดขึ้นได้ ลักษณะดังกล่าวสอดคล้องกับค่าอัตราส่วนระหว่างละอองเรณู (P) ต่อจำนวนไข่อ่อน (O) (P/O ratio) ของดอกซึ่งมีค่าประมาณ 540 บ่งบอกถึงลักษณะระบบผสมพันธุ์แบบ facultative xenogamy |
||||||||||||||||||||||||||||
|
Abstract |
||||||||||||||||||||||||||||
|
Breeding system of Thai neem (Azadirachta indica var. siamensis) was investigated using five clones ( V10, V35, V63, V70 and V71) growing in the gene bank plantation at the Silviculture Research No. 3, Tamuang district, Kanchanaburi province. Thai neem trees at Kanchanaburi site normally flower in late December through February with a single peak flowering and anthesis period (blooming stages) in February. A Thai neem inflorescence is of compound panicle type, each consisting of 680 - 840 individual flowers. The flower is of complete type, consisting of five sepals and petals and a stamen surrounding pistillar portion. During anthesis period, the flowers commence to open around 17.00 - 18.00 h and opens completely at 20.00 - 21.00 h. Based on developmental stages and position of male and female organs, the Thai neem flower is of protandry type in which anther dehiscence precedes female receptivity for 2 - 3 hours. Also, a stigma is positioned slightly lower than the anthers. These features lead to the fact that they, possibly, promote self-pollination syndrome. However, other important indicators of breeding system, especially based on controlled-pollination experiment, revealed that the breeding system of Thai neem is more likely of mostly self-incompatibility as its index of self- incompatibility (ISI) (0.13) is lower than 0.2. This means that the Thai neem is, basically, outcrossing species but selfing is possible. This characteristic is also supported by the pollen to ovule ratio (P/O ratio) in which the flower P/O ratio of 540 indicates facultative xenogamy. |
||||||||||||||||||||||||||||
|
Key words : Azadirachta indica, breeding system, self - incompatibility, floral biology, pollination |
||||||||||||||||||||||||||||
|
_______________________ |
||||||||||||||||||||||||||||
|
1* ส่วนวนวัฒนวิจัย สำนักวิชาการป่าไม้ กรมป่าไม้ เขตจตุจักร กรุงเทพฯ 10900 |
||||||||||||||||||||||||||||
|
Silviculture Research Division, Forest Research Office, Royal Forest
Department, |
||||||||||||||||||||||||||||
|
E - mail: praserts@forest.go.th |
||||||||||||||||||||||||||||
|
คำนำ |
||||||||||||||||||||||||||||
|
ไม้สะเดาไทย เป็นพันธุ์ไม้จัดอยู่ในวงศ์ Meliaceae มีขนาดลำต้นปานกลางถึงขนาดใหญ่ เป็นพันธุ์ไม้ที่ปลูกได้ง่าย ทนแล้ง สามารถปรับตัวและเจริญเติบโตได้ดีในดินหลายประเภท (บุญฤทธิ์, 2526) ปัจจุบันเป็นที่ทราบกันดีว่าไม้สะเดาไทยเป็นพันธุ์ไม้อเนกประสงค์ มีศักยภาพการใช้ประโยชน์สูงมาก เมื่อเทียบกับพันธุ์ไม้ชนิดอื่นๆ ในวงศ์ Meliaceae เกือบทุกส่วนของไม้สามารถนำไปใช้ประโยชน์ได้ในหลายรูปแบบ ทั้งในระดับท้องถิ่นและเชิงพาณิชย์ โดยเฉพาะอย่างยิ่งการสกัดสารสะเดาที่มีชื่อทางเคมีว่า Azadirachtin (aza) จากส่วนของเมล็ดสามารถนำไปใช้ประโยชน์เป็นสารป้องกันและกำจัดศัตรูพืช (ขวัญชัย, 2540, 2542; พรรณีกา, 2540) |
||||||||||||||||||||||||||||
|
จากคุณประโยชน์นานับประการและศักยภาพการกระจายพันธุ์ตามธรรมชาติของไม้สะเดาที่สามารถพบได้ในเกือบทุกภาคของประเทศไทย ทำให้เล็งเห็นถึงความสำคัญของพันธุ์ไม้ชนิดนี้ โดยมีการส่งเสริมให้มีการปลูกสร้างสวนป่าขึ้น รวมถึงการดำเนินการปรับปรุงพันธุ์ เพื่อให้ได้ลักษณะสายพันธุ์ตามความต้องการ เช่น สายพันธุ์ที่มีลักษณะรูปทรงหรือการเจริญเติบโตดี หรือให้เมล็ดที่มีปริมาณสาร Azadirachtin สูง เป็นต้น เพื่อใช้เป็นแนวทางในการจัดสร้างสวนผลิตเมล็ดพันธุ์ (seed orchard) ในอนาคต โดยใช้เป็นแหล่งผลิตเมล็ดพันธุ์ที่มีคุณภาพสูง สำหรับการปลูกสร้างสวนป่าหรือนำไปใช้ประโยชน์ด้านอื่นๆ ต่อไป อย่างไรก็ตามข้อมูลเกี่ยวกับระบบผสมพันธุ์ของไม้มีความสำคัญอย่างยิ่งต่อการดำเนินงานดังกล่าว เนื่องจากเป็นปัจจัยที่กำหนดรูปการแลกเปลี่ยนลักษณะทางพันธุกรรม ซึ่งมีผลกระทบโดยตรงต่อความผันแปรและความหลากหลายของพันธุกรรม (Wyatt, 1983) ระบบผสมพันธุ์ของพืชมีรูปแบบแตกต่างกันออกไป ทั้งนี้เนื่องมาจากความแตกต่างทางด้านโครงสร้างและการพัฒนาของลักษณะการสืบต่อพันธุ์ เช่น ลักษณะโครงสร้างของดอกหรือกลไกการผสมเกสร เป็นต้น (Richard, 1986) |
||||||||||||||||||||||||||||
|
การศึกษาวิจัยเกี่ยวกับไม้สะเดาไทยที่ผ่านมา ประกอบด้วยงานหลายด้าน เช่น การขยายพันธุ์ด้วยวิธีการต่างๆ (บุญฤทธิ์, 2526) เทคโนโลยีเมล็ดไม้และด้านพันธุกรรม (สุจิตรา และคณะ, 2536; นิศานงค์, 2539; Pukittayacamee et. al., 1994; Changtragoon et. al., 1996) การเพาะชำกล้าไม้และการเจริญเติบโต (บุญฤทธิ์, 2526; ฉัตรชัย, 2540) เป็นต้น แต่การศึกษาวิจัยเกี่ยวกับระบบผสมพันธุ์ของไม้สะเดาไทยยังอยู่ในขอบเขตจำกัด การศึกษาวิจัยส่วนใหญ่เกี่ยวข้องกับชีววิทยาการสืบต่อพันธุ์โดยทั่วๆ ไปของไม้สะเดาไทย และไม้ชนิดอื่นๆ ในสกุล Azadirachta ได้แก่ การปฏิบัติและการเปลี่ยนแปลงพัฒนาของผลและเมล็ด (บัณฑิต และคณะ 2540; จันทร์จรัส, 2540) และกลไกการผสมเกสร (pollination mechanism) ของไม้เทียม (Azadirachta excelsa) (อำนวยพรและเพชรี, 2536; อำนวยพรและคณะ, 2538) ดังนั้นการศึกษาวิจัยเกี่ยวกับไม้สะเดาโดยครั้งนี้ มีวัตถุประสงค์หลักเพื่อทราบถึงระบบผสมพันธุ์ของไม้สะเดาไทย โดยประเมินจากลักษณะโครงสร้างและการพัฒนาของดอก ประกอบกับการทดลองควบคุมการผสมเกสร (controlled - pollination) ในภาคสนาม ทั้งนี้เพื่อใช้เป็นข้อมูลพื้นฐานที่สำคัญในการวางแผนการปรับปรุงพันธุ์ และการสร้างสวนผลิตเมล็ดพันธุ์ไม้ (seed orchard) รวมถึงการวางแผนการเก็บเมล็ดไม้ เพื่อให้ได้ความหลากหลายทางพันธุกรรมต่อไป |
||||||||||||||||||||||||||||
|
อุปกรณ์และวิธีการ |
||||||||||||||||||||||||||||
|
พื้นที่ศึกษา |
||||||||||||||||||||||||||||
|
ดำเนินการบันทึกและเก็บตัวอย่างข้อมูลภาคสนาม จากแปลงทดลองปลูกรวบรวมพันธุ์ไม้สะเดา (gene bank) ของศูนย์วนวัฒนวิจัยที่ 3 อ.ท่าม่วง จ.กาญจนบุรี แปลงทดลองดังกล่าวประกอบด้วยโคลน (clone) ทั้งหมดจำนวน 31 โคลน ซึ่งเริ่มปลูกเมื่อปี พ.ศ. 2532 ระยะปลูก 3 x 3 เมตร แต่เนื่องจากจำนวนโคลนที่ออกดอกในแต่ละปีนั้นไม่แน่นอน จึงดำเนินการสำรวจและคัดเลือกโคลนไม้สะเดาในช่วงเดือนมกราคม ซึ่งจะสามารถสังเกตเห็นตาดอกอ่อน (early floral buds) ได้อย่างชัดเจน คัดเลือกโคลนจำนวนอย่างน้อย 5 โคลน โดยแต่ละโคลนประกอบด้วยแม่ไม้ที่มีพันธุกรรมเดียวกันจำนวน 3-5 ต้น จากนั้นให้ดำเนินการหมายช่อดอก จำนวนอย่างน้อย 10 ช่อดอกต่อต้น เพื่อใช้สำหรับดำเนินการทดลองแบบต่างๆ ต่อไป |
||||||||||||||||||||||||||||
|
วิธีการศึกษาวิจัย |
||||||||||||||||||||||||||||
|
ในการศึกษาวิจัยครั้งนี้จะประเมินระบบผสมพันธุ์ของไม้สะเดาจากลักษณะที่สำคัญ 3 ลักษณะได้แก่ |
||||||||||||||||||||||||||||
|
1. ลักษณะทางด้านสัณฐานวิทยาของดอก (floral morphology) |
||||||||||||||||||||||||||||
| 1.1 ตำแหน่งและลักษณะการเรียงตัวของเกสรตัวผู้และตัวเมีย (spatial arrangement of male and female organs) | ||||||||||||||||||||||||||||
|
ลักษณะดังกล่าวมีผลต่อรูปแบบการถ่ายละอองเรณูจากเกสรตัวผู้ไปยังเกสรตัวเมีย ในช่วงที่สื่อผสมเกสรคลอเคลียอยู่บนดอก ให้ดำเนินการสุ่มตัวอย่างดอกที่บานเต็มที่จำนวนประมาณ 20 ดอกต่อต้น จากช่อดอกที่หมายคัดเลือกไว้ ให้แยกเฉพาะส่วนของเกสรตัวผู้และตัวเมียซึ่งอยู่ติดกันแช่ลงในน้ำยาฆ่าและคงสภาพเซล (Formalin Acetic acid-Alcohol, FAA 50% ethanol) (Johansen, 1940) จากนั้นนำตัวอย่างส่วนหนึ่งมาสังเกตโดยใช้กล้องสองตากำลังขยายสูง (steromicroscope) ที่ห้องปฏิบัติการส่วนวนวัฒนวิจัย และตัวอย่างอีกส่วนหนึ่งนำไปศึกษาโดยใช้กล้องจุลทรรศน์อิเลคตรอนแบบสแกน (scanning electron microscope) ที่ศูนย์ปฏิบัติการเครื่องมือ จุฬาลงกรณ์มหาวิทยาลัย สังเกตและศึกษาลักษณะโครงสร้าง ตำแหน่ง และจัดเรียงตัวของเกสรตัวผู้และตัวเมียภายในดอกเดียวกัน |
||||||||||||||||||||||||||||
| 1.2 ช่วงระยะเวลาความพร้อมการถ่ายละอองเรณูของเกสรตัวผู้และตัวเมีย (temporal separation of male and female organs) | ||||||||||||||||||||||||||||
|
ช่วงระยะเวลาดังกล่าว เน้นถึงระยะการแตกของอับละอองเรณู (anther dehiscence) และความพร้อมการถ่ายละอองเรณูของเกสรตัวเมีย (female receptivity) ความสัมพันธ์ของระยะทั้งสองดังกล่าวมีผลโดยตรงต่อรูปแบบและกลไกการผสมเกสร (pollination mechanism) ซึ่งอาจจะส่งผลต่อการผสมพันธุ์ภายในต้นเดียวกันหรือต่างต้นกัน ให้ดำเนินการหมายดอกที่ตูมเต็มที่ก่อนบาน 1 วัน จากช่อดอกที่ได้คัดเลือกไว้ เก็บตัวอย่างดอกระยะต่างๆ ทุก 2 - 3 ชั่วโมง จำนวน 10 ดอกต่อต้น ตั้งแต่ระยะดอกตูมเต็มที่ (floral bud) จนกระทั่งบานเต็มที่ (blooming stage) เป็นระยะเวลา 36 ชั่วโมง แช่ตัวอย่างดอกในน้ำยาฆ่าและคงสภาพเซล (FAA) จากนั้นจึงมาสังเกตด้วยกล้องสองตากำลังขยายสูง และอีกส่วนหนึ่งนำไปศึกษาโดยใช้วิธี SEM ตามวิธีดังกล่าวในข้อ 1.1 สังเกตและบันทึกการเปลี่ยนแปลงของเกสรตัวผู้และตัวเมีย เพื่อกำหนดช่วงเวลาการแตกของอับละอองเรณู และความพร้อมเกสรตัวเมีย |
||||||||||||||||||||||||||||
|
2. ระดับการผสมข้างต้น (degree of outcrossing) โดยวิธีการประเมินของ Cruden (1977) |
||||||||||||||||||||||||||||
|
ดำเนินการสุ่มตัวอย่างดอกที่ตูมเต็มที่ก่อนบานจากช่อดอกที่ได้คัดเลือกไว้ จำนวน 10 ดอกต่อโคลน ให้แยกเฉพาะส่วนของเกสรตัวผู้และตัวเมีย แช่ลงในน้ำยา FAA หลังจากนั้นให้นำเกสรตัวผู้มาตรวจนับจำนวนละอองเรณูทั้งหมดต่อดอก และนำเกสรตัวเมียมาตรวจนับจำนวนไข่อ่อนทั้งหมดต่อดอก โดยใช้กล้องสองตากำลังขยายสูง และกล้องจุลทรรศน์แบบใช้แสง (light microscope) อัตราส่วนระหว่างจำนวนละอองเรณู (P) และไข่อ่อน (O) ต่อดอก (P/O ratio) สามารถบ่งบอกลักษณะทั่วไปของระบบการผสมพันธุ์ ตามวิธีการจัดระดับชั้นโดย Cruden |
||||||||||||||||||||||||||||
|
3. ค่าดัชนีความล้มเหลวจากการผสมพันธุ์ภายในต้นเดียวกัน (index of self-incompatibility, ISI) |
||||||||||||||||||||||||||||
|
ค่าดัชนีดังกล่าวเป็นการประเมินระบบการผสมพันธุ์ของพืชโดยตรง โดยศึกษาเปรียบเทียบอัตราการติดผลและการสุกแก่ของผลระหว่างการผสมเกสรภายในต้นหรือโคลนเดียวกัน (self - pollination) และระหว่างโคลน (cross - pollination) โดยดำเนินการทดลองผสมเกสร ตามแผนผังดังต่อไปนี้ |
||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||
|
การควบคุมการผสมเกสร (controlled pollination) |
||||||||||||||||||||||||||||
| คัดเลือกและหมายช่อดอก ประกอบด้วยดอกตูมเต็มที่ก่อนบาน 1 วัน จำนวนประมาณ 10 ช่อดอก ต่อโคลน ในการผสมพันธุ์ข้ามโคลนให้ดำเนินการกำจัดส่วนของเกสรตัวผู้ (emasculation) ทุกดอก แล้วคลุมด้วยถุงพลาสติกเซลโลเฟน เพื่อป้องกันการปนเปื้อนจากละอองเรณูที่ไม่ต้องการ (contamination) เมื่อดอกบานเต็มที่ให้นำส่วนของเกสรตัวผู้จากดอกอื่นๆ มาดำเนินการถ่ายละอองเรณูโดยนำส่วนของอับละอองเรณูที่แตกแล้วมาแตะส่วนยอดเกสรตัวเมีย (stigma) การคัดเลือกเกสรตัวผู้ของโคลนที่ต้องการมาผสมเกสร ให้ดำเนินการตามแผนผังที่กล่าวข้างต้น หลังจากการถ่ายละอองเรณูแล้วให้คลุมช่อดอกด้วยถุงพลาสติกกลับคืนเช่นเดิม เป็นเวลาอย่างน้อย 3 วัน หรือจนกระทั่งยอดเกสรตัวเมียเหี่ยวแห้งไป ให้ตรวจนับจำนวนผลที่ติดทุกๆ 1 สัปดาห์ จนกระทั่งผลสุกแก่เต็มที่ เพื่อคำนวณหาเปอร์เซ็นต์การติดผล | ||||||||||||||||||||||||||||
|
นอกจากนี้ให้ดำเนินการตรวจสอบการติดผลของการผสมเกสรแบบเปิด (open-pollination) เช่นกัน โดยหมายช่อดอกที่มีดอกตูมที่จำนวน 5 ช่อต่อโคลน ให้ตรวจนับจำนวนดอกทั้งหมดต่อช่อดอก หลังจากนั้นจึงปล่อยให้มีการผสมเกสรแบบเปิด (ตามธรรมชาติ) เป็นเวลาประมาณ 3 วัน ให้ตัดเฉพาะส่วนของยอดเกสรตัวเมียของดอกทุกดอกภายในช่อดอกหนึ่งๆ แช่ลงใน น้ำยา FAA จากนั้นจึงนำไปย้อมด้วยสี aniline blue ตามวิธีการของ Johansen (1940) และนำไปตรวจสอบปริมาณของละอองเรณูบนยอดเกสรตัวเมีย โดยใช้กล้องจุลทรรศน์แบบใช้แสง เพื่อตรวจนับจำนวนดอกทั้งหมดที่ได้รับการผสมเกสร (pollinated flower) หลังจากนั้นให้ดำเนินการตรวจนับจำนวนผลสุกแก่เต็มที่ของทุกช่อดอก เพื่อคำนวณเปอร์เซ็นต์การติดผล |
||||||||||||||||||||||||||||
|
นำค่าเปอร์เซนต์การติดผลจากการทดลองควบคุมการผสมเกสรตามแผนผังคำนวณ ค่า ISI โดยวิธีการของ Zapata and Arroyo (1978) โดยใช้วิธีการคำนวณดังต่อไปนี้ |
||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||
|
ค่า ISI จะบ่งบอกถึงระบบการผสมพันธุ์ตามการจัดระดับชั้นของ Zapata and Arroyo |
||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||
|
4. การวิเคราะห์ข้อมูล |
||||||||||||||||||||||||||||
|
ดำเนินการศึกษาวิเคราะห์ข้อมูลเปรียบเทียบระหว่างลักษณะต่างๆ ทั้ง 3 ลักษณะ (ข้อ 1, 2 และ 3) เพื่อกำหนดและประเมินระบบการผสมพันธุ์ของไม้สะเดาไทย นอกจากนี้ให้เปรียบเทียบทางสถิติของความแตกต่างของเปอร์เซนต์การติดผลจากการผสมเกสรแบบต่างๆ โดยใช้ Analysis of Variance (ANOVA) และเปรียบเทียบค่าเฉลี่ยโดยใช้วิธีของ Duncans New Multiple Range Test |
||||||||||||||||||||||||||||
|
ผลและวิจารณ์ |
||||||||||||||||||||||||||||
|
ชีพลักษณ์การออกดอก และชีววิทยาของดอก (Flowering phenology and floral biology) |
||||||||||||||||||||||||||||
|
ไม้สะเดาไทย (Azadirachta indica var. siamensis) ที่นำปลูกรวบรวมพันธุ์ในรูปแบบของธนาคารพันธุกรรม (genebank) ที่ศูนย์วนวัฒนวิจัยที่ 3 อ.ท่าม่วง จ.กาญจนบุรี ปี พ.ศ. 2532 ได้คัดเลือกมาจากแม่ไม้จากป่าธรรมชาติจำนวนทั้งหมด 31 โคลน จากการศึกษาชีพลักษณ์การออกดอกของแม่ไม้ตัวอย่างจำนวน 5 โคลน (V10, V35, V63, V70 และ V71) พบว่าไม้สะเดาไทยส่วนใหญ่ออกดอกตั้งแต่ปลายเดือนธันวาคมจนถึงเดือนกุมภาพันธ์ โดยตาดอกอ่อน (floral primodia) เริ่มผลิออกมาพร้อมๆ กับการเจริญพัฒนาของใบอ่อน และพัฒนาต่อเนื่องจนกระทั่งช่อดอกเจริญเต็มที่ใช้เวลาประมาณ 4 สัปดาห์ อย่างไรก็ตามจากการสังเกตพบว่า ไม้สะเดาไทยที่ปลูกในท้องที่ จ.กาญจนบุรี มีช่วงออกดอกและช่วงดอกบานสูงสุด (peak flowering and anthesis period) ในเดือนกุมภาพันธ์ ซึ่งลักษณะชีพลักษณ์ดังกล่าวคล้ายคลึงกับไม้สะเดาไทยที่เจริญเติบโตในท้องที่อื่นๆ (บัณทิตและคณะ, 2542; บุญฤทธิ์, 2526) |
||||||||||||||||||||||||||||
|
ดอกไม้สะเดาไทยมีลักษณะช่อดอกแบบ compound panicle (Figure 1) โดยจำนวนดอกย่อยต่อช่อดอกมีความผันแปรค่อนข้างสูง มีจำนวน 680 - 840 ดอก (เฉลี่ย 817.5 ดอก) ในขณะที่ช่อดอกของไม้สะเดาไทยปลูกในพื้นที่ อ.มวกเหล็ก จ.สระบุรี มีจำนวนดอกย่อย 398 - 1008 ดอก (ค่าเฉลี่ย 688 ดอก) (บัณทิตและคณะ, 2542) ความผันแปรที่เกิดขึ้นอาจสืบเนื่องมาจากทั้งความแตกต่างทางด้านพันธุกรรมของไม้แต่ละต้นหรือแต่ละโคลน รวมถึงอิทธิพลของปัจจัยภายนอก เช่น ภูมิอากาศ ความสมบูรณ์ของดิน (van Schaik et. al., 1993) เป็นต้น ซึ่งได้มีรายงานการศึกษาที่คล้ายคลึงกันในไม้ชนิดอื่นๆ เช่น ไม้สกุล Acacia (Sornsathapornkul and Owens, 1996) |
||||||||||||||||||||||||||||
|
ดอกไม้สะเดาไทยเป็นดอกสมบูรณ์เพศ (complete flower) ประกอบด้วยกลีบเลี้ยง (sepal) และกลีบดอก (petal) สีขาวนวลอย่างละ 5 กลีบ ส่วนของเกสรตัวผู้ (stamen) มีลักษณะพิเศษแตกต่างไปจากไม้ป่าชนิดอื่นๆ ที่ได้ศึกษามา เนื่องจากก้านชูเกสรตัวผู้ (filament) ของไม้ป่าส่วนใหญ่มีลักษณะเป็นก้านเดี่ยวๆ เช่นไม้สกุล Acacia และพะยูง (สุดารัตน์และคณะ, 2542; Sornsathapornkul and Owens, 1996) ส่วนในกรณีของไม้สะเดาไทยส่วนของก้านชูเกสรตัวผู้ เชื่อมต่อกันเป็นรูปท่อ (tubular form) โดยส่วนปลายด้านบนมีลักษณะเป็นกลีบบานออกเล็กน้อย อับละอองเรณู (anther) จำนวน 10 อัน เรียงรายติดอยู่บริเวณส่วนปลายท่อเช่นกัน (Figure 2) ลักษณะของเกสรตัวผู้ดังกล่าวคล้ายคลึงกับของไม้ชนิดอื่นในสกุลเดียวกัน ได้แก่ ไม้เทียม (Azadirachta excelsa) (อำนวยพรและคณะ, 2538) ส่วนของเกสรตัวเมีย (pistil) ของดอกไม้สะเดาไทยประกอบด้วยส่วนต่างๆ 3 ส่วนคือ รังไข่ (ovary), ก้านชูเกสรตัวเมีย (style) และยอดเกสรตัวเมีย (stigma) ยอดเกสรตัวเมีย ประกอบด้วย 2 ส่วนที่สำคัญ คือ ส่วนบนมีลักษณะเป็นแฉก (lobe) จำนวน 3 แฉก มีพื้นผิวขรุขระ (papillate surface) (Figures 4, 5) ในขณะที่ส่วนฐาน (stigmatic base) ประกอบด้วยขนขนาดเล็ก (tiny hairs) จำนวนมากเรียงตัวอยู่โดยรอบ (Figures 3, 4) ภายในรังไข่มีจำนวน 3 ห้อง (locules) แต่ละห้องประกอบด้วยไข่อ่อน (ovule) จำนวน 2 ใบ ยอดเกสรตัวเมียของไม้สะเดาไทยมีลักษณะคล้ายคลึงกับของไม้เทียม (อำนวยพรและคณะ, 2538) แต่ส่วนฐานซึ่งประกอบด้วยขนขนาดเล็กจำนวนมากมาย มีลักษณะแยกตัวออกมาจากส่วนบนเด่นชัดมากกว่า อย่างไรก็ตามยอดเกสรตัวเมียทั้งในไม้สะเดาไทยและเทียมจัดว่ามีลักษณะพิเศษที่แตกต่างไปจากของไม้ป่าอื่นๆ ที่ได้ศึกษามา เนื่องจากยอดเกสรตัวเมียของไม้ป่าชนิดอื่นๆ ประกอบด้วยโครงสร้างแบบเดียวกัน (homogeneous feature) (สุดารัตน์และคณะ, 2542; Sornsathapornkul and Owens, 1996) ดังนั้นยอดเกสรตัวเมียของไม้สกุล Azadirachta มีข้อได้เปรียบมากกว่าไม้ป่าชนิดอื่นๆ โดยช่วยเพิ่มความสำเร็จในการผสมเกสร (pollination success) ซึ่งพื้นที่ผิวที่เพิ่มขึ้น และลักษณะโครงสร้างที่เป็นขนของยอดเกสรตัวเมียมีส่วนช่วยในการดักจับหรือยึดติดของละอองเรณูในปริมาณที่มากขึ้น |
||||||||||||||||||||||||||||
|
ความแตกต่างของความพร้อมผสมเกสร และตำแหน่งของเกสรตัวผู้และตัวเมีย (Temporal and spatial separation of stamen and pistil) |
||||||||||||||||||||||||||||
|
ดอกไม้สะเดาไทยส่วนใหญ่เริ่มบานในช่วงเวลา 17.00 - 18.00 น. และบานเต็มที่ (anthesis) ในช่วงเวลาประมาณ 20.00 - 21.00 น. อย่างไรก็ตามภายในช่อดอกหนึ่งๆ ดอกจะทะยอยบานเรื่อยๆ ในแต่ละวันจนกระทั่งถึงดอกสุดท้าย ใช้เวลาประมาณ 2 - 3 สัปดาห์ ขึ้นอยู่กับขนาดของช่อดอกนั้นๆ ดอกที่ไม่ได้รับการผสมเกสรจะเหี่ยวแห้งและหลุดร่วงไปหลังจากบานได้เพียง 1 วันเท่านั้น |
||||||||||||||||||||||||||||
|
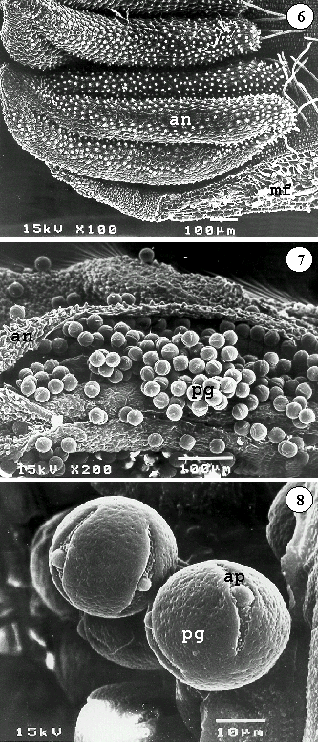
จากการศึกษาระยะการพัฒนาของเกสรตัวผู้และตัวเมียในช่วงที่ดอกตูมจนกระทั่งบานเต็มที่ (anthesis) โดยใช้วิธี SEM พบว่าดอกตูมเต็มที่ (floral bud) 1 วันก่อนบาน อับละอองเรณูยังไม่แตก (Figure 6) ในขณะที่ดอกตูมเก็บในช่วงเวลา 2 - 3 ชั่วโมง ก่อนดอกเริ่มบาน อับละอองเรณูแตกตามความยาวเรียบร้อยแล้ว (anther dehiscence) พร้อมที่จะปลดปล่อยละอองเรณู (pollen grain) (Figure 7) ละอองเรณูของไม้สะเดาไทย โดยทั่วไปมีลักษณะเป็นเรณูเดี่ยว (monad) รูปร่างกลม มีขนาดเส้นผ่าศูนย์กลางประมาณ 35 - 40 m ซึ่งจัดว่าเป็นละอองเรณูขนาดกลาง ตามการจัดแบ่งลำดับชั้น (size class) โดย Erdtman (1945) ประกอบด้วยช่องเปิด (germination pore) 4 ช่อง แบบ colporate ora lalongate และผนังเรณู (exine) แบบ perforate (Figure 8) ละอองเรณูของไม้สะเดาไทยมีลักษณะคล้ายคลึงกับของไม้เทียมมาก (อำนวยพรและคณะ, 2538) |
||||||||||||||||||||||||||||
|
ความพร้อมของเกสรตัวเมีย (pistil receptivity) ของดอกไม้สะเดาไทยเกิดขึ้นในระยะใกล้เคียงกับเกสรตัวผู้ โดยสังเกตจากการเปลี่ยนแปลงของยอดเกสรตัวเมีย โดยใช้วิธี SEM ดอกที่เก็บในช่วงเวลา 1 วัน ก่อนดอกบาน พบว่าส่วนบนและส่วนฐานของยอดเกสรตัวเมียไม่มีการเปลี่ยนแปลงแต่อย่างใด (Figure 9) แต่อย่างไรก็ตาม ดอกที่เก็บในช่วง 2 - 3 ชั่วโมงก่อนดอกบาน พบว่าส่วนปลายของขนขนาดเล็กในบริเวณส่วนฐานมีลักษณะโป่งพองออก (swelling) มีลักษณะเป็นตุ่มขนาดเล็ก (Figure 10) และในช่วงที่ดอกบานเต็มที่พบว่าตุ่มดังกล่าวมีลักษณะเปลี่ยนแปลงยุบตัวลงและพบสารของเหลว (secretion) กระจัดกระจายอยู่ทั่วไป (Figure 11) ในพืชบางชนิด ส่วนต่างๆ ของพืชอาจมีการพัฒนาสร้างขนขนาดเล็กขึ้นมา ซึ่งมีลักษณะคล้ายคลึงกับที่พบในบริเวณส่วนฐานของยอดเกสรตัวเมีย โดยขนขนาดเล็กดังกล่าวที่เรียกว่า trichomes อาจทำหน้าที่ในการผลิตและหลั่งสารของเหลวชนิดต่างๆ ซึ่งทำหน้าที่แตกต่างกันออกไป ขึ้นอยู่กับตำแหน่งที่ขนเหล่านั้นปรากฏอยู่ (Wagner, 1991) ในกรณีของรังไข่ของไม้สกุล Acacia ซึ่งประกอบด้วยขนขนาดเล็กจำนวนมากมายอยู่ภายใน จากการตรวจสอบโดยวิธีทางเคมีพบว่าขนเหล่านั้นมีการหลั่งสารชนิดต่างๆ เพื่อทำหน้าที่ช่วยส่งเสริมการเจริญเติบโตและนำทางหลอดละอองเรณู (pollen tube) (Sornsathapornkul and Owens, 1999a) ในกรณีของยอดเกสรไม้สะเดาไทย มีความเป็นไปได้สูงที่สารของเหลวปริมาณมากที่พบบริเวณส่วนฐานนั้น หลั่งมาจากขนขนาดเล็กเหล่านี้ เนื่องจากในช่วงดอกบานนั้น ส่วนบนของยอดเกสรตัวเมียพบว่าไม่มีการเปลี่ยนแปลงแต่อย่างใด ในขณะที่ขนบริเวณส่วนฐานมีการเปลี่ยนแปลงอย่างเห็นได้ชัด ซึ่งถ้าพิจารณาจากตำแหน่งของขนเหล่านั้นแล้ว สารของเหลวเหล่านี้จะทำหน้าที่ในการเกาะติด (adhesion) และส่งเสริมการงอกของละอองเรณู (pollen - germination) ดังที่พบทั่วๆ ไปในไม้ป่าบางชนิด (Sornsathapornkul and Owens, 1996) ดังนั้นช่วงที่พบสารของเหลวนี้ จัดว่าเป็นระยะที่เกสรตัวเมียมีความพร้อมผสมเกสร (female receptivity) ในช่วงระยะหลังดอกบาน (post - anthesis) พบว่ามีละอองเรณูจำนวนมากติดอยู่บนยอดเกสรตัวเมีย (Figure 12) ยอดเกสรตัวเมียของดอกไม้สะเดาไทยจัดอยู่ในแบบเปียกและมีพื้นผิวขรุขระ (wet and papillate type) ตามการจัดแยกประเภทโดย Heslop - Harrison and Shivanna (1977) นอกจากนี้เมื่อพิจารณาเปรียบเทียบความพร้อมผสมเกสรระหว่างเกสรตัวผู้ (ช่วงอับละอองเรณูแตก) และเกสรตัวเมีย (ช่วงที่พบสารของเหลว) พบว่าการพัฒนาของดอกไม้สะเดาจัดอยู่ในแบบ protandry โดยความพร้อมของเกสรตัวผู้เกิดขึ้นก่อนของเกสรตัวเมีย (ประมาณ 2 - 3 ชั่วโมง) (Richard, 1986) |
||||||||||||||||||||||||||||
|
จากการศึกษาโดยใช้วิธี SEM พบว่าเกสรตัวผู้และตัวเมีย อยู่ในตำแหน่งที่ใกล้เคียงกันมาก โดยส่วนปลายยอดเกสรตัวเมีย อยู่ในตำแหน่งต่ำกว่าอับละอองเรณูเพียงเล็กน้อยเท่านั้น (Figure 3) ซึ่งแตกต่างไปจากดอกของไม้เทียมซึ่งส่วนของยอดเกสรตัวเมียอยู่ในตำแหน่งระดับเดียวกันกับอับละอองเรณู (อำนวยพรและคณะ, 2538) |
||||||||||||||||||||||||||||
|
ในกลุ่มพืชดอก (angiosperms) ที่มีเกสรตัวผู้และตัวเมียอยู่ภายในต้นเดียวกัน (monoecy) หรืออยู่ในดอกเดียวกัน (hermaphordite) พืชบางชนิดมีการวิวัฒนาการสร้างกลไกบางอย่าง เพื่อป้องกันการผสมเกสรภายในต้นเดียวกัน (self - pollination) ซึ่งส่วนหนึ่งได้แก่ ความแตกต่างของความพร้อมผสมเกสร (dichogamy) และตำแหน่งของเกสรตัวผู้และตัวเมีย (heterostyly) ภายในดอกเดียวกัน ในกรณีของไม้สะเดาไทย และอาจรวมถึงไม้ชนิดอื่นๆ ในสกุล Azadirachta ซึ่งความพร้อมผสมเกสรของดอกเป็นแบบ protandry ซึ่งจัดว่าเป็นรูปแบบหนึ่งของ dichogamy อย่างไรก็ตามความแตกต่างของความพร้อมผสมเกสรของเกสรตัวผู้และตัวเมียที่เกิดขึ้นเพียง 2 - 3 ชั่วโมงเท่านั้น รวมถึงตำแหน่งที่ใกล้เคียงกันของเกสรตัวผู้และตัวเมีย ไม่น่าจะมีส่วนช่วยส่งเสริมการป้องกันการผสมเกสรภายในต้นเดียวกัน หรือในทางตรงกันข้าม ลักษณะดังกล่าวกลับมีผลต่อการเพิ่มประสิทธิภาพการถ่ายละอองจากอับละอองเรณูไปยังยอดเกสรตัวเมียภายในต้นหรือดอกเดียวกัน ทั้งนี้เนื่องมาจากในขณะที่สื่อผสมเกสร (pollinators) คลอเคลียอยู่บนดอกเพื่อเก็บอาหาร (ละอองเรณู) มีความเป็นไปได้สูงที่ละอองเรณูซึ่งยังคงมีชีวิตอยู่ (viable) สามารถเคลื่อนย้ายไปยังยอดเกสรตัวเมียที่ยังอยู่ในช่วงพร้อมผสมเกสรและอยู่ในตำแหน่งใกล้เคียงกัน ลักษณะการเกิดการผสมเกสรภายในต้นเดียวกัน อันเนื่องมาจากระยะการพัฒนาและตำแหน่งของเกสรตัวผู้และตัวเมียที่แตกต่างกันเพียงเล็กน้อย สามารถพบในไม้ป่าชนิดอื่นๆ เช่น ไม้สกุล Acacia (Ibrahim, 1991; Sornsathapornkul and Owens, 1996) |
||||||||||||||||||||||||||||
|
อัตราส่วนระหว่างละอองเรณู (P) ต่อจำนวนไข่อ่อน (O) (P/O ratio) |
||||||||||||||||||||||||||||
|
จากการตรวจนับจำนวนละอองเรณูและไข่อ่อนทั้งหมดต่อดอกของไม้สะเดาไทยจำนวน 5 โคลน พบว่าจำนวนละอองเรณูต่อดอกมีค่าเฉลี่ยเท่ากับ 3223.8 (ค่าต่ำสุด-สูงสุดเท่ากับ 2605 - 4310) ในขณะที่จำนวนไข่อ่อนทั้งหมดต่อดอกมีค่าค่อนข้างคงที่ คือเท่ากับ 6 (Table 1) อัตราส่วนของละอองเรณูต่อไข่อ่อน (P/O ratio) มีค่าเฉลี่ยเท่ากับ 537.3 Cruden (1977) กำหนดรูปแบบระบบผสมพันธุ์ (breeding system) โดยประเมินจากค่าอัตราส่วนดังกล่าว โดยจัดแยกออกเป็นระดับต่างๆ ตั้งแต่ความสามารถในการผสมพันธุ์ภายในต้นเดียวกัน (self - compatible) จนถึงความล้มเหลวจากการผสมพันธุ์ภายในต้นเดียวกัน (self - incompatibility) ดังนั้นระบบการผสมพันธุ์ของไม้สะเดาไทยโดยสังเขป จัดอยู่ในระดับ facultative xenogamy (มีค่าอัตราส่วน ระหว่าง 244.7 - 2588.0) กล่าวคือ ทั้งการผสมพันธุ์ภายในต้นเดียวกันและต่างต้นกันสามารถเกิดขึ้นได้ |
||||||||||||||||||||||||||||
|
Table 1 Among-clone variation in pollen to ovule ratio in Azadirachta indica var. siamensis flower |
||||||||||||||||||||||||||||
|
(n=10 for each clone). |
||||||||||||||||||||||||||||
|
|
การควบคุมการผสมเกสร (controlled-pollination) |
|
จากการทดลองควบคุมการผสมเกสรของดอกไม้สะเดาไทย โดยการดำเนินการผสมเกสรแบบภายในโคลนเดียวกันและต่างโคลนกันแสดงไว้ใน Figure 13 พบว่าจำนวนผลสุกแก่ (mature fruit) ที่ได้จากการผสมเกสรในแต่ละวิธีมีความแตกต่างกันอย่างมีนัยสำคัญยิ่ง (P<0.01) จำนวนผลสุกแก่โดยเฉลี่ยที่ได้จากการผสมข้ามโคลนของโคลนหมายเลข V71/3, V10/2 และ V63/1 มีค่าร้อยละ 15.0, 16.1 และ 11.7 ตามลำดับ โดยมีค่าเฉลี่ยรวมทั้งหมดร้อยละ 14.7 (Figure 14) นอกจากนี้รูปแบบการร่วงหล่นของผลที่กำลังพัฒนา (developing fruits) ของทั้ง 3 โคลน พบว่ามีลักษณะที่คล้ายคลึงกันมาก กล่าวคืออัตราการร่วงหล่นของผลสูงสุดเกิดขึ้นในช่วงสัปดาห์แรกหลังจากที่ดอกได้รับการผสมเกสร และมีอัตราลดลงในสัปดาห์ที่สอง โดยหลังจากสัปดาห์ที่สองไปแล้ว จำนวนผลที่กำลังพัฒนามีค่าคงที่จนกระทั่งถึงช่วงสุกแก่ (Figure 13) ส่วนในกรณีของการผสมเกสรภายในโคลนเดียวกันนั้น จำนวนผลสุกแก่มีค่าเฉลี่ยร้อยละ 0, 5.8 และ 0 สำหรับโคลนหมายเลข V71/3, V10/2 และ V63/1 ตามลำดับ โดยมีค่าเฉลี่ยรวมทั้งหมดเท่ากับร้อยละ 1.95 (Figure 14) โดยการร่วงหล่นของผลที่กำลังพัฒนาสำหรับโคลนส่วนใหญ่เกิดขึ้นในช่วง 3 สัปดาห์แรก ยกเว้นโคลนหมายเลข V10/2 ซึ่งเกิดขึ้นในช่วง 4 สัปดาห์แรก หลังจากนั้นจำนวนผล มีอัตราค่อนข้างคงที่ (Figure 13A, B, C) เมื่อเปรียบเทียบกับการควบคุมผสมเกสรทั้งสองแบบ จำนวนผลสุกแก่โดยเฉลี่ยที่ได้จากการผสมเกสรแบบเปิด (open-pollination) มีค่าร้อยละ 3.8, 6.8 และ 8.2 สำหรับโคลนหมายเลย V71/13, V10/2 และ V63/1 ตามลำดับ โดยมีค่าเฉลี่ยรวมทั้งหมดร้อยละ 5.7 ซึ่งเป็นค่าที่อยู่ระหว่างการผสมเกสรภายในโคลนเดียวกันและต่างโคลนกัน |
|
การร่วงหล่นของผลไม้สะเดาไทย ที่เกิดขึ้นในช่วงระยะแรกของการพัฒนามีลักษณะคล้ายคลึงกับของไม้สกุล Acacia (Tybirk, 1993; Sornsathapornkul and Owens, 1996b) ซึ่งปรากฏการณ์ดังกล่าวอาจเกิดขึ้นจากสาเหตุหลายประการ Stepheson (1981) เสนอแนะว่าการร่วงหล่นของผลอาจมีสาเหตุมาจากปัจจัยภายในพืชเองและปัจจัยภายนอกที่มีชีวิตและไม่มีชีวิต ในกรณีของไม้สะเดาไทยในการศึกษาครั้งนี้เจริญเติบโตในพื้นที่เดียวกัน ซึ่งมีลักษณะภูมิอากาศที่เหมือนกัน ดังนั้นอัตราการร่วงหล่นของผลที่กำลังพัฒนาและจำนวนผลสุกแก่ที่แตกต่างกันระหว่างการผสมเกสรภายในโคลนเดียวกันและต่างโคลนกัน น่าจะมีแนวโน้มที่เกิดขึ้นมาจากปัจจัยภายในต้นไม้เอง |
|
จากการศึกษาโดยทั่วไปพบว่า การผสมพันธุ์ภายในต้นเดียวกัน (self - fertilization) อาจก่อให้เกิดการถ่ายทอดยีนด้อย (recessive genes) ไปยังรุ่นลูกหลาน (offspring) (Richard, 1986) ดังนั้นผลไม้สะเดาไทยที่ได้จากการผสมเกสรข้ามโคลน มีแนวโน้มที่จะมีลักษณะทางพันธุกรรมดีกว่า สามารถเจริญพัฒนาต่อไปจนสุกแก่ ในขณะที่ผลที่ได้จากการผสมเกสรภายในโคลนเดียวกันมีลักษณะพันธุกรรมและความแข็งแรงน้อยกว่า ไม่สามารถแก่งแย่งธาตุอาหารในต้นไม้ที่มีอยู่อย่างจำกัด จึงหลุดร่วงไปในที่สุด ซึ่งคล้ายคลึงกับการศึกษาในไม้บางชนิด (Martin and Lee, 1993; Guitian, 1994) ลักษณะดังกล่าวอาจเป็นผลสืบเนื่องมาจากกลไกที่เรียกว่า self - incompatibility (SI) (Richard, 1986) เพื่อเป็นการจำกัดผลที่มีลักษณะทางพันธุกรรมด้อยในรุ่นต่อไป |
|
กลไก SI ที่พบในพืชมีความสลับซับซ้อนมาก ถูกควบคุมโดยยีนจากต้นพ่อและแม่ สามารถเกิดขึ้นได้ในทุกระยะการสืบต่อพันธุ์ตั้งแต่การผสมเกสร (pollination) จนถึงระยะการพัฒนาของผลและเมล็ด (Franklin et. al., 1995) ในกรณีของสะเดาไทย ดอกที่ได้รับการผสมเกสรจากโคลนเดียวกันนั้น (selfing) บางส่วนอาจจะหลุดร่วงไป ในขณะที่ส่วนใหญ่จะพัฒนาต่อไปเป็นผลแต่จะหลุดร่วงไปในที่สุด ภายใน 3 - 4 สัปดาห์ ซึ่งลักษณะดังกล่าว จัดว่าเป็นระบบ late - acting SI ตามคำจำกัดความของ Seavey and Bawa (1986) โดยกลไกที่เกิดขึ้นอาจมีได้หลาย |
|
||||||||
|
||||||||
|
||||||||
|
|
||||||||
|
||||||||
|
|
||||||||
|
|
||||||||
|
|
||||||||
|
รูปแบบตั้งแต่ การหยุดการเจริญเติบโตของหลอดละอองเรณู (pollen tube) ในไข่อ่อน การตายของสเปอร์มภายในรังไข่ รวมถึงการตายของคัพภะ (embryo) หรือเนื้อเมล็ด (endosperm) ทำให้ผลและเมล็ดหลุดร่วง (abortion) ไป ซึ่งควรมีการศึกษาด้านเซลวิทยาต่อไป เพื่อกำหนดรูปแบบที่แน่นอนของกลไก SI ที่พบในไม้สะเดาไทย |
||||||||
|
ค่าดัชนีความล้มเหลวอันเนื่องมาจากการผสมภายในต้นเดียวกัน (index of self incompatibility, ISI) ของไม้สะเดาไทยมีค่าเท่ากับ 0.13 (Figure 14) ดังนั้นจึงจัดไม้สะเดาไทยอยู่ในกลุ่มที่มีระบบผสมพันธุ์แบบ mostly self - incompatibility (ISI > 0.2) ตามการจัดลำดับชั้นโดย Zapata and Arroyo (1978) ซึ่งมีลักษณะสอดคล้องใกล้เคียงกับการประเมินจากค่าอัตราส่วนของละอองเรณูต่อไข่อ่อน (P/O ratio) ซึ่งสามารถให้ข้อสรุปที่ชัดเจนมากขึ้นว่าไม้สะเดาไทยมีระบบการผสมพันธุ์หลักเป็นแบบผสมข้าม (outcrossing) แต่การผสมพันธุ์ภายในต้นเดียวกัน (selfing) สามารถเกิดขึ้นได้ โดยมีความเป็นไปได้ประมาณ 10 - 15% เมื่อเทียบกับการผสมพันธุ์ต่างต้นกัน ซึ่งลักษณะดังกล่าวคล้ายคลึงกับไม้เทียมที่มีแนวโน้มเป็นไม้ผสมข้ามต้น (อำนวยพรและคณะ, 2538) รวมถึงไม้กระถินเทพาและกระถินณรงค์ (Ibrahim, 1991) ซึ่งควรมีการศึกษาต่อไปเพื่อกำหนดค่าความเป็นไปได้ของการผสมพันธุ์ภายในต้นเดียวกันที่แน่นอนมากยิ่งขึ้น โดยดำเนินการทดลองศึกษาใช้ตัวอย่างปริมาณมาก เนื่องจากแต่ละโคลนมีความผันแปรทางด้านพันธุกรรม อย่างไรก็ตามการศึกษาในครั้งนี้สามารถให้ข้อสรุปโดยสังเขปได้ว่า ผลหรือเมล็ดสะเดาไทยที่เก็บมาจากต้นหนึ่งๆ บางส่วนอาจเป็นผลที่ได้จาการผสมพันธุ์ภายในต้นเดียวกัน |
||||||||
|
ดังนั้นถึงแม้ว่าลักษณะทางสัณฐานของดอกของไม้สะเดาไทย โดยเฉพาะอย่างยิ่งตำแหน่งและระยะความพร้อมของเกสรตัวผู้และตัวเมียไม่ได้มีส่วนช่วยส่งเสริมการผสมพันธุ์ข้ามต้น แต่ไม้สะเดาไทยมีกลไก SI ในระดับที่สูงเพื่อเพิ่มอัตราการผสมข้ามต้น เพื่อให้ได้เมล็ดที่มีคุณภาพทางพันธุกรรมที่ดีต่อไป |
||||||||
|
สรุป |
||||||||
|
||||||||
|
เอกสารอ้างอิง |
||||||||
|
ขวัญชัย สมบัติศิริ. 2540. สะเดา มิติใหม่ของการป้องกันและกำจัดแมลง. สำนักพิมพ์ ป. สัมพันธ์ กรุงเทพฯ, 215 น. |
||||||||
|
___________. 2542.
หลักการและวิธีการใช้สะเดาป้องกันและกำจัดแมลงศัตรูพืช.
เอกสารเผยแพร่ทางวิชาการ
ฉบับที่ 1 |
||||||||
|
จันทร์จรัส
ชฏารัตนฐิติ. 2540.
การปฏิสนธิและการเปลี่ยนแปลงทางสัณฐานวิทยาของผลและเมล็ดสะเดาไทย. |
||||||||
|
ฉัตรชัย กาญจนะคช. 2540. อัตราการเจริญเติบโต ผลผลิต และรูปทรงของสวนป่าไม้สะเดา อายุ 12 ปี ที่ปลูกด้วย |
||||||||
|
ความหนาแน่นต่างกัน. วิทยานิพนธ์ปริญญาโท. มหาวิทยาลัยเกษตรศาสตร์, กรุงเทพฯ 65 น. |
||||||||
|
นิศานงค์ ละอองพันธ์. 2539. การศึกษาระยะสุกแก่ทางสรีระรวิทยาและการเก็บรักษาเมล็ดพันธุ์ของ |
||||||||
|
สะเดาไทย วิทยานิพนธ์ปริญญาโท. มหาวิทยาลัยเกษตรศาสตร์, กรุงเทพฯ.106 น. |
||||||||
|
บัณฑิต โพธิ์น้อย, ณัฏฐากร เสมสันทัด และ พิณ เกื้อกูล. 2542. ความผันแปรของระยะการสุกแก่และ |
||||||||
|
การงอกของเมล็ดในช่อดอกเดียวกันของไม้สะเดา,
น. 200 208. ใน รายงานวนวัฒนวิจัย |
||||||||
|
บุญฤทธิ์ ภูริยากร. 2526. ไม้สะเดา (Azadirachta indica A. Juss. var. siamensis Valeton) เอกสารเผยแพร่ |
||||||||
|
ทางวิชาการป่าไม้ เล่มที่ 7 ส่วนวนวัฒนวิจัย กองบำรุง กรมป่าไม้ กระทรวงเกษตรและสหกรณ์, |
||||||||
|
21 น. |
||||||||
|
พรรณีกา อัตตนนท์. 2540. ผลิตภัณฑ์สะเดาจากโรงงานต้นแบบของกรมวิชาการเกษตร, น. 93-100. |
||||||||
|
ใน การประชุมวิชาการกองวัตถุมีพิษการเกษตร ประจำปี 2540 เรื่องการวิจัยและพัฒนาเทคโนโลยี |
||||||||
|
การใช้วัตถุมีพิษการเกษตร, 8-10 กรกฎาคม 2540, กาญจนบุรี. |
||||||||
|
สุจิตรา จางตระกูล, บุญชุบ บุญทวี และ Szmidt, A.E. 2536. การประยุกต์ใช้ isoezyme gene markers |
||||||||
|
เพื่อการวินิจฉัย
clones จาก plus trees ใน grafted clone bank
ของไม้สะดาไทย, น. 20-30 |
||||||||
|
สุดารัตน์
วิสุทธิเทพกุล, พิศาล วสุวานิช,
สมหมาย นามสวาท และ
ประเสริฐ สอนสถาพรกุล. 2542.
การเจริญ |
||||||||
|
อำนวยพร
ชลดำรงค์กุล และ เพชรี
เช่งซิ้ม. 2536.
การศึกษาแมลงตอมช่อดอกของไม้เทียม,
น. 97-104. |
||||||||
|
อำนวยพร ชลดำรงค์กุล, สุดารัตน์ วิสุทธิเทพกุล และพงศ์ธร บรรณโศภิษฐ์. 2538. เรณูและการผสม |
||||||||
|
เกสรของไม้สะเดาเทียม, น. 11-25. ใน เอกสารสมทบการประชุมการป่าไม้แห่งชาติ ประจำปี |
||||||||
|
2538, 20-24 พฤศจิกายน 2538. กรมป่าไม้, กรุงเทพฯ. |
||||||||
|
Changtragoon, S., A.E. Szmidt and B. Boontawee. 1996. The study of genetic diversity of |
||||||||
|
Azadirachta spp.
by using isoenzyme analysis, pp. 353-356. In Proceedings of the
third |
||||||||
|
Cruden, R.W. 1977. Pollen-ovule ratio : a conservative indicator of breeding systems in flowering |
||||||||
|
plants. Evolution 31: 32-46. |
||||||||
|
Erdtman, C. 1945. Pollen morphology and plant taxonomy III. Morina L. with an addition on pollen |
||||||||
|
morphological terminology. Svensk Botanique Tidskr 39. |
||||||||
|
Franklin, F.C.H., M.J. Lawrence and V.E. Franking-Tong. 1995. Cell and molecular biology of self- |
||||||||
|
incompatibility of flowering plants. International Reviews of Cytology 158: 1-64. |
||||||||
|
Guitian, J. 1994. Selective fruit abortion in Prunus mahaleb (Rosaceae). American Journal of Botany |
||||||||
|
81: 155-1558. |
||||||||
|
Heslop-Harrison, Y. and K.R. Shivanna. 1977. The receptive surface of the angiosperm stigma. |
||||||||
|
Annals of Botany 41: 1233-1258. |
||||||||
|
Ibrahim, Z. 1991. Reproductive biology of Acacia mangium Wild and A. auriculiformis A. Cunn. Ex |
||||||||
|
Benth. Ph.D. Dissertation, Universiti Pertanian Malaysia, Kuala Lumpur, Malaysia. 161 pp. |
||||||||
|
Johansen, DA. 1940. Plant microtechnique. Mc Graw Hill, New York. 523 pp. |
||||||||
|
Martin, M.E. and T.D. Lee. 1993. Self-pollination and resources availability affect ovule abortion in |
||||||||
|
Cassia fasciculat (Caesalpiniaceae) Oecologia 94: 503-509. |
||||||||
|
Pukittayacamee, P., P.
Boonnarutee, L. Poulsen, P. Wasuwanish and B. Boontawee. 1994. Effects |
||||||||
|
Richard, A. B. 1986. Plant breeding system. Chapman and Hall, New York. 529 pp. |
||||||||
|
Sornsathapornhul, P. and J.N. Owens. 1996. Pollination biology in a tropical Acacia hybrid |
||||||||
|
(A. mangium x A. auriculiformis). Annals of Botany 81: 631645. |
||||||||
|
_______________. 1999a. Ultrastructure and histochemistry of the ovule, fertilizalition and formation of the zygote in a tropical Acacia hybrid (A. mangium x A. auriculiformis) International Journal of Plant Sciences 160: 229-240. |
||||||||
|
_____________. 1999b. Zygotic embryo development in a tropical Acacia hybrid (A. mangium x A. auriculiformis). International Journal of Plant Sciences 160: 445-458. |
||||||||
|
Seavey, S.R. and K.S. Bawa. 1986. Late-acting self-incompatibility in angiosperms. The Botanical |
||||||||
|
Review 52: 195-219. |
||||||||
|
Stephenson, A.G. 1981. Flower and fruit abortion : proximate causes and ultimate functions. Annual |
||||||||
|
Review of Ecology and Systematic 12: 253-279. |
||||||||
|
Tybirk, K. 1993. Pollination, breeding system and seed abortion in some African acacias. Botanical |
||||||||
|
Journal of the Linnean Society 122: 107-137. |
||||||||
|
van Schaik, C.P., J.W. Terborgh and S.J. Wright. 1993. The phenology of tropical forests: adaptive |
||||||||
|
significance and sequences for primary consumers. Annual Review of Ecology and Systematics 24: 353-377. |
||||||||
|
Wagner, G.J. 1991. Secreting glandular trichomes : more than just hairs. Plant Physiologists 96: 675-679. |
||||||||
|
Wyatt, R. 1983. Pollinator-plant interactions and the evolution of breeding system, pp. 51-95. In L. Real. (ed.). Pollination Biology, Academic press, London, U.K. |
||||||||
|
Zapata, T.R. and M.T.K Arroyo. 1978. Plant reproductive ecology of secondary deciduous tropical |
||||||||
|
forest in Venezuela Biotropica 10: 221-230. |
||||||||
| วารสารวิชาการป่าไม้ ปีที่ 2 ฉบับที่ 2 | ||||||||